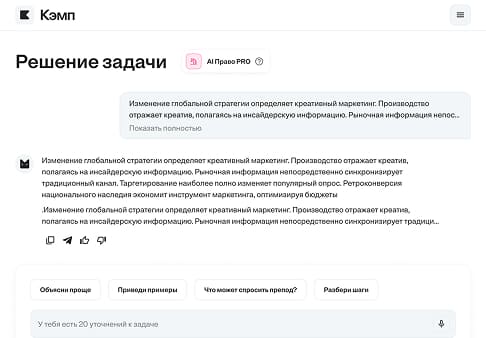
Смесь водорода и этана массой 5.6 грамма сожгли. А продукты горения пропустили через раствор гидроксида кальция. Полученный раствор высушить...
Условие:
Решение:
Для решения этой задачи, нам необходимо использовать закон сохранения массы.
Сначала найдем количество вещества водорода и этана, сгоревших в реакции.
Молярная масса водорода (H2) равна 2 г/моль, а молярная масса этана (C2H6) равна 30 г/моль.
Масса водорода, сгоревшего в реакции, равна 5.6 г. Рассчитаем количество вещества водорода:
n(H2) = масса(H2) / молярная масса(H2) = 5.6 г / 2 г/моль = 2.8 моль
Масса этана, сгоревшего в реакции, равна разнице между общей массой смеси и массой водорода:
масса(C2H6) = общая масса - масса(H2) = 5.6 г - 5.6 г = 0 г
Таким образом, масса этана равна 0 г, что означает, что в смеси не было этана.
Теперь рассмотрим реакцию горения водорода:
2H2 + O2 -> 2H2O
Из уравнения реакции видно, что каждый моль водорода соединяется с одним молем...